Hasta la fecha, hay más de 28,000 publicaciones que detallan el uso de la espectroscopia de RM para una amplia gama de trastornos neurológicos, sin embargo, esta técnica prometedora no se ha utilizado completamente en la práctica clínica. Los recientes avances en tecnología están abordando estos problemas para traducir la espectroscopia MR desde la mesa de trabajo hasta la cabecera.
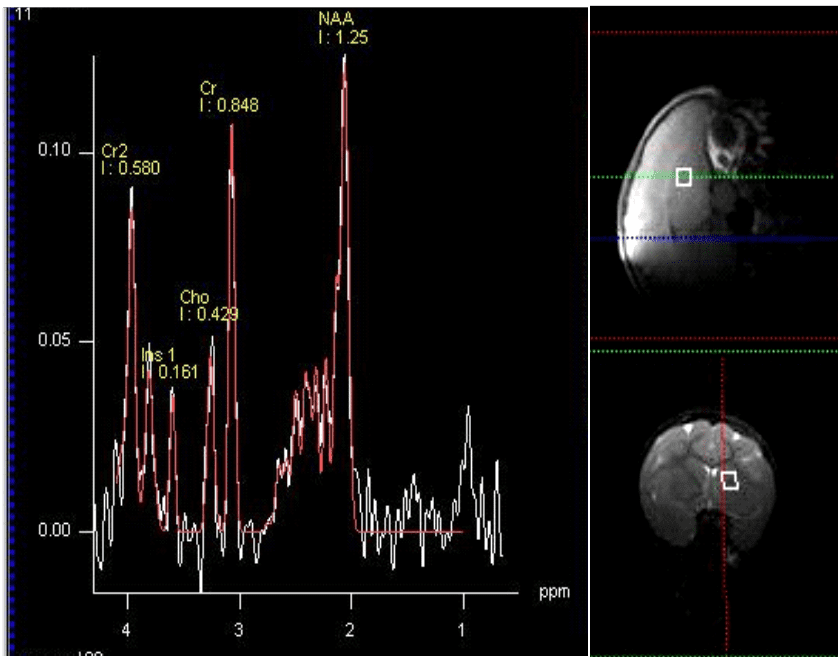
La espectroscopia por MR es ideal para mediciones repetidas y para medir resultados terapéuticos mediante la obtención de señales químicas o metabolitos de una región de interés. Se genera un espectro de picos, por lo que cada pico refleja un producto químico que resuena a una frecuencia específica (descrita en partes por millón o ppm); la altura del pico refleja la concentración de ese químico en el cerebro (descrito como una proporción de creatina, unidades institucionales o concentración milimolar).
Con la espectroscopia MR se pueden detectar diferentes metabolitos y sus funciones biológicas se pueden utilizar para proporcionar una perspectiva fisiopatológica para el diagnóstico y la monitorización del tratamiento.
A pesar de las miles de publicaciones que demuestran la precisión y el valor diagnóstico de la espectroscopia de MR, esta técnica prometedora no se ha utilizado completamente en la práctica clínica debido a dos problemas principales: 1) desafíos de adquisición de datos, 2) falta de integración del análisis de datos en el proceso clínico.
A diferencia de las secuencias de imágenes de MR en las que se adquiere todo el cerebro, la espectroscopia de MR es como una biopsia virtual donde se debe seleccionar una región de interés. Esto plantea algunos desafíos para los tecnólogos, aunque los avances en la tecnología (como las mejoras en los algoritmos de reducción automática) han eliminado en gran medida la necesidad de realizar ajustes manuales que requieren mucho tiempo.
El desarrollo de secuencias de espectroscopia de MR más avanzadas, como las imágenes de desplazamiento químico, también permite una mayor resolución espacial y permite la reconstrucción post-hoc de datos de regiones seleccionadas, aunque con cierto sacrificio de señal a ruido.
Sin embargo, estos avances también plantean el tema de la estandarización de las metodologías, ya que la literatura científica está fragmentada por diferentes métodos. La Sociedad Internacional de Resonancia Magnética en Medicina se ha enfrentado a este desafío al establecer un grupo de consenso de espectroscopia MR para establecer la estandarización de los métodos en todos los proveedores.
Actualmente, las únicas herramientas de reconstrucción por espectroscopia MR aprobadas por la FDA de cada proveedor (por ejemplo, GE FuncTool, Siemens Syngo, Philips FreeWave) utilizan diferentes métodos de reconstrucción de datos y no proporcionan un análisis profundo.
Por un lado, las herramientas de investigación realizan métodos de procesamiento avanzados y proporcionan una cuantificación de metabolitos de alta calidad (es decir, LCModel, jMRUI, AQSES, Tarquin). Sin embargo, estos sistemas requieren conocimientos expertos para configurar y operar, y no están bien integrados en la línea clínica, o carecen de la aprobación de la FDA (es decir, SIVIC). Sin embargo, los avances en el software del fabricante están en marcha. Los paquetes de software de terceros están buscando llenar este vacío (es decir, BrainSpec). Estos avances tecnológicos recientes ayudarán a traducir la espectroscopia de RM en clínica, tomando la tecnología del futuro, en nuestras clínicas actuales.
Fuente: “Making the ‘virtual biopsy’ a reality with MR spectroscopy.” — DOTmed
Traducido y editado por el Equipo Editorial de ResidenciasMedicas.com.ar